# 物理化学第12章:化学动力学基础(2)
- 化学动力学是研究化学反应速率及其影响因素的分支。第12章深入探讨了动态过程中的重要概念、理论和应用。以下是对本章内容的拆解。
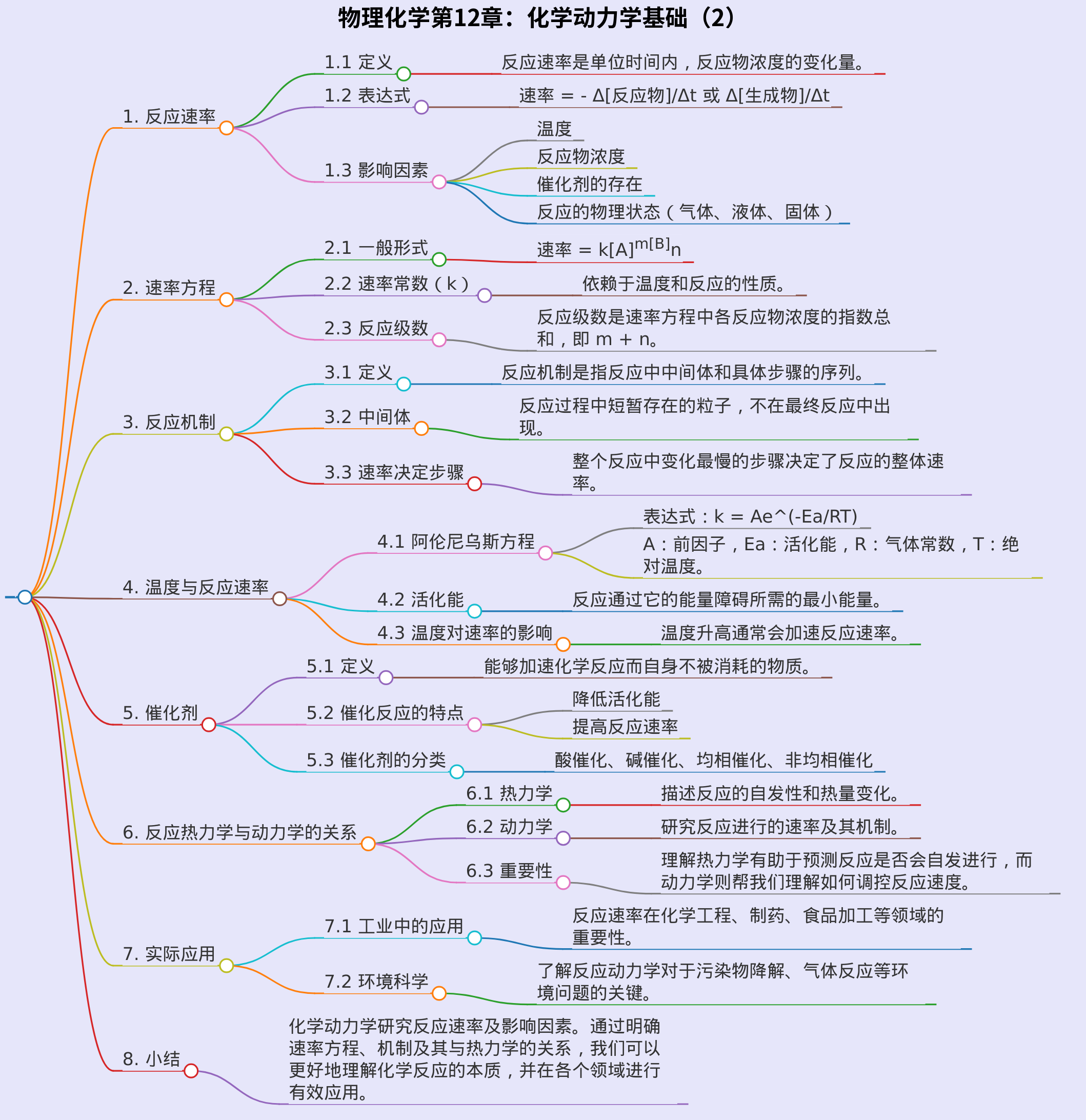
## 1. 反应速率
### 1.1 定义
- 反应速率是单位时间内,反应物浓度的变化量。
### 1.2 表达式
- 速率 = - Δ[反应物]/Δt 或 Δ[生成物]/Δt
### 1.3 影响因素
- 温度
- 反应物浓度
- 催化剂的存在
- 反应的物理状态(气体、液体、固体)
## 2. 速率方程
### 2.1 一般形式
- 速率 = k[A]^m[B]^n
### 2.2 速率常数(k)
- 依赖于温度和反应的性质。
### 2.3 反应级数
- 反应级数是速率方程中各反应物浓度的指数总和,即 m + n。
## 3. 反应机制
### 3.1 定义
- 反应机制是指反应中中间体和具体步骤的序列。
### 3.2 中间体
- 反应过程中短暂存在的粒子,不在最终反应中出现。
### 3.3 速率决定步骤
- 整个反应中变化最慢的步骤决定了反应的整体速率。
## 4. 温度与反应速率
### 4.1 阿伦尼乌斯方程
- 表达式:k = Ae^(-Ea/RT)
- A:前因子,Ea:活化能,R:气体常数,T:绝对温度。
### 4.2 活化能
- 反应通过它的能量障碍所需的最小能量。
### 4.3 温度对速率的影响
- 温度升高通常会加速反应速率。
## 5. 催化剂
### 5.1 定义
- 能够加速化学反应而自身不被消耗的物质。
### 5.2 催化反应的特点
- 降低活化能
- 提高反应速率
### 5.3 催化剂的分类
- 酸催化、碱催化、均相催化、非均相催化
## 6. 反应热力学与动力学的关系
### 6.1 热力学
- 描述反应的自发性和热量变化。
### 6.2 动力学
- 研究反应进行的速率及其机制。
### 6.3 重要性
- 理解热力学有助于预测反应是否会自发进行,而动力学则帮我们理解如何调控反应速度。
## 7. 实际应用
### 7.1 工业中的应用
- 反应速率在化学工程、制药、食品加工等领域的重要性。
### 7.2 环境科学
- 了解反应动力学对于污染物降解、气体反应等环境问题的关键。
## 8. 小结
- 化学动力学研究反应速率及影响因素。通过明确速率方程、机制及其与热力学的关系,我们可以更好地理解化学反应的本质,并在各个领域进行有效应用。
---
以上是《物理化学》第12章“化学动力学基础”的主要内容拆解,便于理解和记忆。
复制内容
下载markdown文件
在线编辑