# 物理化学第10章:电解与极化作用
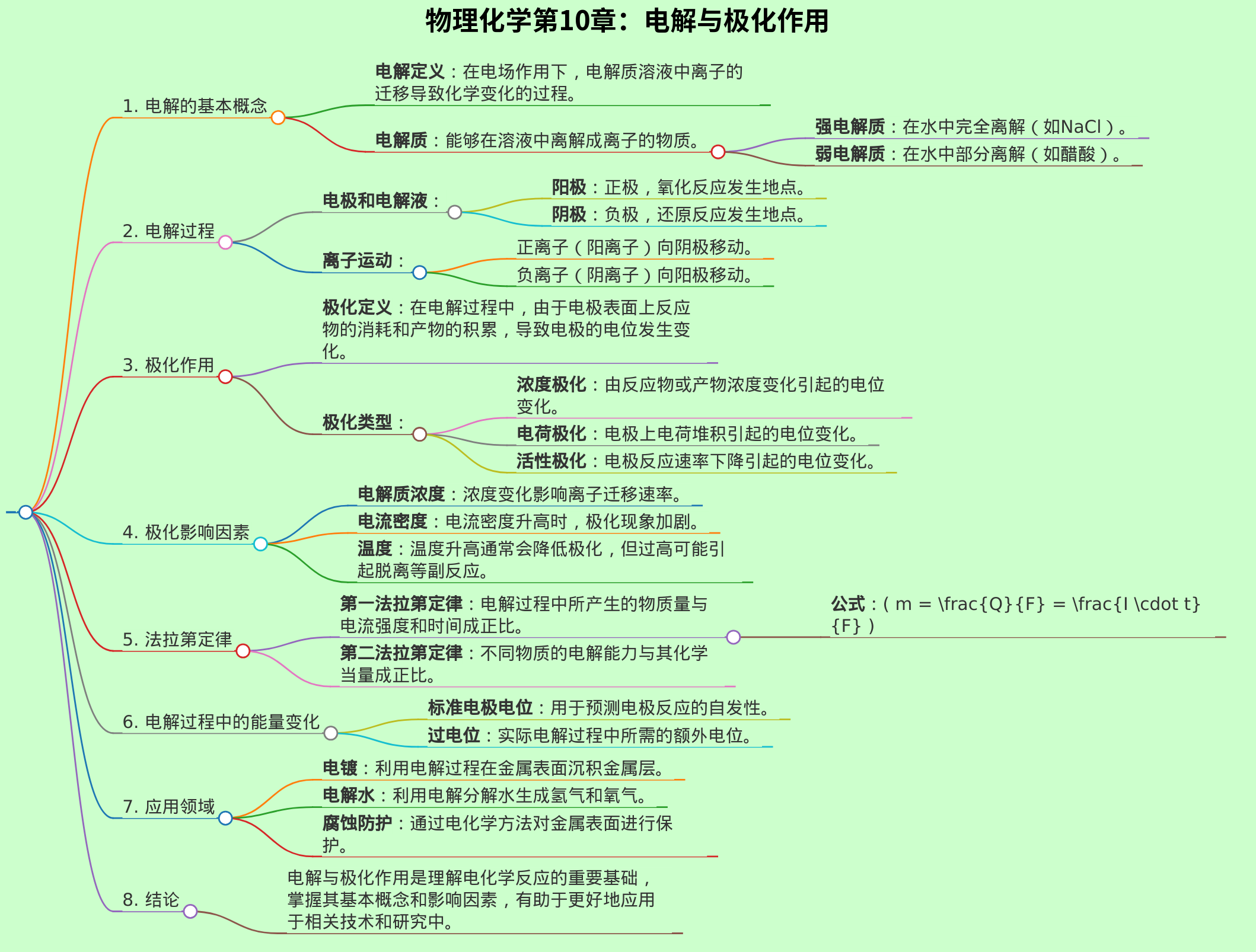
## 1. 电解基础
- **定义**:电解是通过电流使化学反应进行的过程。
- **电解质**:
- **强电解质**:完全离解成离子(如NaCl)。
- **弱电解质**:部分离解成离子(如醋酸)。
- **导电性**:
- **溶液导电性**:由离子浓度和电解质种类决定。
- **固体导电性**:取决于电子或离子的移动性。
## 2. 电解过程
- **电解槽**:
- 组成部分:阳极、阴极、电解质溶液或熔融物质。
- **电极反应**:
- **阳极反应**:氧化反应,失去电子。
- **阴极反应**:还原反应,获得电子。
- **电流的方向**:由阳极流向阴极,电子则反向流动。
## 3. 荷电转移
- **法拉第定律**:
- **第一法拉第定律**:电解中物质的质量与电流强度成正比。
- **第二法拉第定律**:电解中不同物质的质量与所需电量成正比。
- **电量计算**:
- 公式:Q = I × t
- 质量计算公式:m = (Q × M) / (n × F)
- Q:电量(库伦)
- I:电流(安培)
- t:时间(秒)
- M:摩尔质量(克/摩尔)
- n:转移的电子数
- F:法拉第常数(约96485 C/mol)
## 4. 极化现象
- **极化定义**:在电解过程中,电极表面由于反应生成的气体或沉淀而阻碍电流的流动。
- **极化类型**:
- **浓度极化**:电解质在电极附近的浓度变化。
- **气体极化**:生成的气体气泡附着于电极表面。
- **极化效应**:
- 提高电解过程的过电位。
- 降低电流效率,增加能量损耗。
## 5. 影响电解和极化的因素
- **电解质浓度**:浓度越高,电导率越好,极化影响减小。
- **电流密度**:电流密度过高会加剧极化现象。
- **温度**:温度升高可增加离子运动速率,降低极化。
## 6. 应用与实例
- **电镀**:利用电解将金属沉积在物体表面。
- **电解水**:将水分解为氢气和氧气。
- **腐蚀**:金属在电解环境中的腐蚀过程。
## 7. 总结
- 电解和极化是化学、电流及离子运动结合的结果。
- 理解法拉第定律和极化现象对于化学反应和电解过程的优化至关重要。
复制内容
下载markdown文件
在线编辑